参考文献
[1] 热力学. 王竹溪, 北京大学出版社 2004
[2] Thermodynamics . Ryogo Kubo, North-Holland Publishing Company 1968
[3] Thermodynamics . Enrico Fermi, Dover Publications 1956
[4] Thermodynamics and Statistical Mechanics . Arnold Sommerfeld, Academic Press 1956
[5] 微分几何讲义 . 周建伟, 科学出版社 2010
[6]
Acknowledgement
在写作本文的过程中,Jyx 检查了文章草稿并给出了宝贵的建议. 特别是文中关于 Clausius 不等式的连续形式的证明思路得益于与 Jyx 的讨论.
热力学杂谈
热力学第一定律
首先考虑热力学第一定律. 平衡态体系存在许多状态参量,其中最为重要的恐怕就是内能和熵. 然而,内能与熵之间亦有不同. 第一定律是说,在任意过程中,内能的变化总是可以归结为传热与做功之和:这就是说热与功都可以同样地改变物体的内能,并且两者的贡献相互独立.
这当然是一种能量守恒律的体现. 然而第一定律的内涵不止于此. 首先就是可以注意到,式子
的左边涉及到体系的内能,而式子的右边则涉及到过程量. 严格来说,外界对系统做功的量 平衡态 的内能之差与传热和做功的联系.
根据文献 [1] 的说法,热量
由此可见,还是直接将内能的存在作为一个经验事实加以接受较为稳妥,或者如文献 [2] pp.5 的处理,说将热量
虽然说第一定律 (1) 中假设体系的初末状态都是平衡态,但实际上内能的概念仍可作大幅度的延申. 这主要利用了以下事实:任何孤立体系在足够长的时间内都会趋于平衡态(文献 [1] pp.6, 文献 [2] pp.2). 这里的"孤立"的含义 是指系统与外界无任何相互作用,并且通常也假设系统被约束在有限的空间范围之内. 譬如说宇宙本身是一个无界系统,因而一般来说不能算作是这里所说的"孤立体系".
现在假设
然而,非平衡系统的熵的定义就远没有这么简单. 譬如说假设有一个隔热刚性盒子中装有处于非平衡态的理想气体,那么经过足够时间后,系统的确会达到一个平衡态. 此时如果稍微增大盒子的体积,譬如说在一个大盒子中撤掉挡板,使得气体分子能到达的有效空间增加,那么系统就会开始向新的平衡态演化. 当系统达到新的平衡态时,内能不变,而熵却会增加!换句话来说,孤立演化过程中,内能守恒,但熵并不是一个守恒量 . 看起来只有加上诸如局域平衡的条件,才能勉强对非平衡系统给出熵的定义.
当然,这是因为熵本身就与过程的不可逆性有关. 譬如说一旦两个不同温度的物体相互接触发生了自发的热传递,那么就不可能将热传递的痕迹完全消除. 这就是说,热传导过程是不可逆的 . 这就是热力学第二定律的 Clausius 表述.
现在讨论热力学第一定律的微分形式. 假设平衡态体系由内能
自然,态函数
一般来说功形式并不是恰当的,因而热量也不是恰当的.
以上关于热力学第一定律的微分形式的讨论都是局限于平衡态流形
热力学中经常需要作自变量的替换,也即将流形
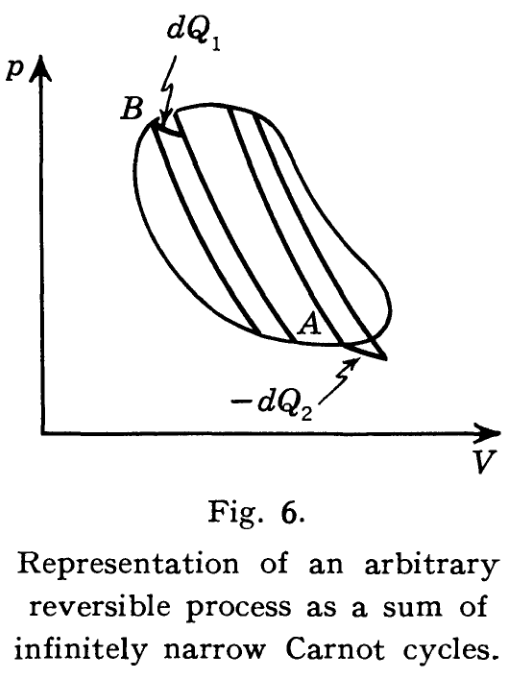
Carnot 定理
根据热力学第二定律的 Kelvin 表述可以导出 Carnot 定理(文献 [1], pp.78, 文献[2], pp.64):
工作在高温热源
至于不等式 对于任意一个过程 . 在这个定义中,并不要求逆过程的每一步都是原过程的反演. 因而这种定义会使得可逆过程的范畴大为增加,同时也使得不可逆过程的范围缩小. 特别地,按照这个定义,可逆过程未必是准静态的,因此即便是可逆 Carnot 热机,其与热源接触时也可能不是一直保持等温的.
有了这个定义,就很容易证明不可逆 Carnot 热机的效率小于可逆 Carnot 热机的效率了:对于一个不可逆的 Carnot 热机,利用与等式
看起来放宽可逆性的定义是严格不等式
由 Carnot 定理以及热机效率的定义可以导出一个新的温标,也即热力学温标:
这个时候,就可以注意到等式
Clausius 不等式
接下来就是 Clausius 不等式的证明: 假设一个系统经历了一个循环过程,在该过程中依次与温度为
不等式
Clausius 不等式的以上证明思路可见于文献 [1] pp.120, 文献 [2] pp.70 以及文献 [3] pp.46.
当不等式
反之,假设不等式
总之,以上讨论证明了 Clausius 不等式 (11) 中的不等号当且仅当循环不可逆时才是严格的.
还有一些值得推敲的细节就是,在 Clausius 不等式的叙述中,似乎默认
其实,只要假设系统与热库的相互作用只涉及到传热,那么 Carnot 热机的思想实验就仍然适用. 毕竟此时导致热源温度变化的原因无非就是与系统之间的传热,因此不妨等到原始循环结束之后,再把热源接上 Carnot 热机进行操作,那么热量
另一个值得注意的地方就是,在系统与不同的热源接触的空挡,是不是默认系统一定是绝热的?至少对于 Carnot 循环来说,当系统不与热源接触时,系统一定是绝热的. 或者说,一般来说默认系统总是从热源吸热或放热,因此如果系统不与任何热源接触,传热就无从谈起. 这个细节对于有限多个热源来说并没有那么碍事,但是对于温度连续变化的情况来说,就有些惹眼了.
为了同时考虑平衡和非平衡过程,以下假设系统的状态空间为增广的状态流形
在接下来导出连续形式的 Clausius 不等式之前,首先需要证明一个关于热源温度可变的 Carnot 热机的引理:
引理 1:设热机工作在两个热源
下面利用离散形式的 Clausius 不等式来推出其连续形式. 这里仍然需要之前提出的一个假设,那就是系统与环境之间的相互作用只涉及到传热 ,也就是说系统对外做功并不是直接对环境做功. 换言之,系统的与外界的相互作用可分为两部分:其一是"热环境",其二则是"力学环境". 一个例子就是封闭在气缸中的气体,缸体本身是透热的,因而气体可以从气缸外部的热源吸收热量;另一方面假设气缸内的活塞是隔热的,因而气体膨胀或收缩时,对活塞所连接的外部机构仅仅是做了功,而没有发生传热. 这就是把系统的总的环境分为了热源和功源两个独立的部分.
其次就是需要假设,当热环境的温度从
接下来就可以开始论证了. 将区间
现在在循环
根据热力学第二定律的 Kelvin 表述,
现在令
下面考虑不等式中的不等号严格成立的条件. 当不等式
反之,假设不等式
总之,现在我们就证明了 Clausius 不等式的连续形式.
熵
对于可逆过程来说, Clausius 不等式成为一个积分等式. 由于其对于态空间
现在令
式
由此即得对于
当然,式
对于参量较多的系统来说,式
表象问题
此处又可引申出一个问题,也即热力学的多种不同的表象. 其实这无非是取态空间
可知该矩阵的行列式为
接下来我们证明广义坐标
显然,该矩阵的行列式等于
熵增加原理
现在讨论任意过程的熵变. 设平衡态
另一方面,假设
另一方面,由于
代入
总之,对于任意过程
当然,如果系统从一个平衡态经历绝热可逆过程到达另一平衡态,那么根据 绝热可逆过程是等熵的 . 另一方面,对于不可逆的绝热过程来说,由
以上的不等式 熵增加原理:孤立体系的熵永远不会减少 :
这个原理对于判断系统自发变动的方向以及判断平衡的稳定性特别有用.
自发过程的方向判定
由熵变的不等式
譬如说对于孤立系统来说,实际过程必定满足 一个常见的论断就是孤立系统在平衡态时必定达到熵的极大值(文献 [2], pp.76): 这里的极大值是关于孤立系统的所有可能的局域平衡态所组成的空间
因此,更合适的说法是:在只考虑热力学第二定律的约束下,孤立系统的平衡态必定达到熵的极大值. 如果考虑无穷小过程,就可以得到孤立系统的实际过程的方向判定条件为
当然可以考虑系统的其他约束条件. 譬如说可以考虑等熵约束
如果进一步考虑与外界没有功交换(作功)的系统,也即 对于与外界没有功交换的等熵系统,在只考虑热力学第二定律的约束下,其在平衡态时必定达到内能的极小值. 也即内能极小原理 .
如果考虑无穷小过程,就可以得到与外界没有能量交换等熵系统的实际过程的方向判定条件,也即
接下来考虑两类有广泛实际应用的约束条件. 其一是考虑等温系统. 那么实际过程所需满足的条件为
如果进一步考虑与外界无功交换的等温系统,譬如对理想气体来说,可以考虑等温等容(且气体质量一定)系统,那么实际过程的方向的判定条件为 对于与外界无功交换的等温系统,在只考虑热力学第二定律的约束下,其在平衡态时必定达到 Helmholtz 自由能的极小值. 也即Helmholtz 自由能极小原理 . 如果考虑无穷小过程,就可以得到与外界无功交换的等温系统的实际过程的方向判定条件,也即
其二是考虑等温等压系统. 这里的"等压"指的是响应函数
这里 对于等温等压系统,在只考虑热力学第二定律的约束下,其在平衡态时必定达到 Gibbs 自由能的极小值. 也即Gibbs 自由能极小原理 . 如果考虑无穷小过程,就可以得到等温等压系统的实际过程的方向判定条件,也即
Helmholtz 自由能
Helmholtz 自由能的一个物理意义就是,考虑系统从
当然,由于 系统在等温过程中所能对外做的最大功正是初态的与末态的 Helmholtz 自由能之差 . 因此 Helmholtz 自由能
自然,由不等式
自发过程的方向性与力学平衡
由
如果两个系统相互接触,其某个特性函数分别为
那么内能
类似地,当
因此,有必要仔细地审查物理学的各个部门所使用的基本的模型和方法论,譬如系统的可加性等等,看看如何抽象为最基本的元素,然后讨论这些元素之组合,以及这些不同组合之间是否相容.
系统与环境的平衡条件
仿照之前的讨论也可以得到系统与环境的平衡条件. 假设系统一直与一个固定的环境接触,环境的温度和响应函数为常量
特别地,当系统一直与环境相接触时,实际的无穷小过程的判断条件为
平衡条件与平衡的稳定性
先前导出的平衡条件,实际上都是假设了系统在平衡态附近,任意无穷小的虚变动都不可能发生. 如果假设系统从任意初态出发,演化足够长时间后所到达的终态(平衡态)是唯一的,与演化历程无关,那么以上假设就是合理的. 在这个假设中,实际上是认为系统达到平衡态后就不再经历任何宏观变化,因而状态空间的任意虚变动都是被禁止的. 这就是说系统的平衡是(局部)稳定的. 如果任意有限的变动都被热力学第二定律所禁止,那么就是说系统的平衡是全局稳定的:在给定约束条件下,任意初态经历足够长的时间后都会到达该平衡态. 譬如说考虑一个孤立系统,其所对应的状态空间
然而许多实际系统也存在所谓的亚稳态乃至于随遇稳态. 亚稳态是说,虽然无穷小的虚变动都是禁止的,但存在一些有限的可发生的变动(跳跃). 这往往与相变相联系. 随遇稳态则是说,系统满足平衡条件
前面也提到了诸如等熵约束、等温约束等约束条件. 在这些约束条件下,可以根据平衡的局部稳定性假设导出一些热力学不等式. 譬如说在等温等容条件下,环境温度固定为
类似地可以得到其他的热力学不等式. 一个最为通用的办法是,考虑等温等压约束,此时系统与温度为
不等式